

Серотонин прежде всего известен как нейромедиатор. Однако эта молекула может вступать в реакции — например, присоединяться к клеточным и внеклеточным белкам, то есть серотонилировать их. Ранее было показано, что серотонилированию подвержены в том числе гистоны — основные белки хроматина, которые не только обеспечивают упаковку ДНК, но и регулируют активность генов. Как серотонилирование связано с экспрессией генов, изучено достаточно плохо, и еще хуже изучены соответствующие молекулярно-физиологические процессы. Исследователи из США показали, что серотонин регулирует развитие опухолей головного мозга, ограничивая экспрессию ключевых транскрипционных факторов и влияя на активность нейронов, которые окружают эти опухоли. Это первая работа, описывающая подобный механизм поддержания злокачественных новообразований.
В поиске способов лечения злокачественных опухолей исследователи изучают не только ее саму, но и окружающие ее здоровые ткани. Буквально в прошлом году журнал Nature опубликовал исследование, которое показало, что глиобластома изменяет нейронные пути пациента, приводя к когнитивным проблемам и снижению выживаемости (S. Krishna et al., 2023. Glioblastoma remodelling of human neural circuits decreases survival). Нейронная активность также увеличивает темпы деления клеток глиомы (V. Venkataramani et al., 2019. Glutamatergic synaptic input to glioma cells drives brain tumour progression). Как оказалось, схожие процессы происходят и в случае эпендимомы — опухоли, состоящей из трансформированных клеток, выстилающих желудочки головного мозга.
Эпендимома (в частности, педиатрическая) — агрессивная опухоль, устойчивая к химиотерапии. У детей пятилетняя выживаемость составляет в среднем 60%, но сильно зависит от молекулярных характеристик опухоли. Одним из самых агрессивных вариантов считается эпендимома с химерным геном ZFTA1-RELA (ZR-FUS; C. Ng et al., 2023. A multi-institutional retrospective pooled outcome analysis of molecularly annotated pediatric supratentorial ZFTA-fused ependymoma). Это значит, что в ДНК таких клеток гены ZFTA1 и RELA, кодирующие белок с цинковыми пальцами, функции которого пока плохо поняты, и транскрипционный фактор экспрессируются как один большой белок. Этот химерный белок связывается с различными хроматиновыми факторами и активирует транскрипцию онкогенов, запускающих опухолевые механизмы в нервных клетках.
Лаборатория Стивена Мака (Stephen C. Mack) из Детского исследовательского госпиталя святого Иуды Фаддея уже давно занимается изучением молекулярных механизмов ZR-FUS-эпендимомы, в том числе разработала ряд мышиных моделей этой опухоли. Лаборатория Бенжамина Денена (Benjamin Deneen) из Медицинского колледжа Бейлора занимается взаимодействием нервных импульсов с клетками опухолей головного мозга. Вместе они предложили гипотезу, что в регуляции развития ZR-FUS-эпендимомы как-то замешан серотонин, который в первую очередь известен как нейромедиатор, на котором завязано множество процессов: от настроения, обучения, чувства удовлетворения до физиологических явлений, таких как регуляция моторики кишечника, сокращения матки, иммунитета и других.
Что же привело их к этой идее? Дело в том, что буквально несколько лет назад исследователи смогли объяснить, что же делает серотонин, который присоединяется к другим белкам. Этот феномен — его называют серотонилированием — был описан еще в конце 1950-х годов: моноаминовые нейромедиаторы (нейромедиаторы с одной аминогруппой: дофамин, серотонин, катехоламины) могут присоединяться к белкам (D. Clarke et al., 1959. The incorporation of amines into protein). Участвует в этом процессе фермент тканевая трансглутаминаза. Только спустя 30 лет после этого стало понятно, что серотонилирование важно для коагуляции крови тромбоцитами (G. Dale et al., 2002. Stimulated platelets use serotonin to enhance their retention of procoagulant proteins on the cell surface).
Однако вопрос с гистонами — основными белками, которые участвуют в упаковке ДНК в ядре и регуляции ее функций, — оставался открытым. Обычно такие модификации (метилирование, ацетилирование, убиквитинирование и др.) контролируют работу хроматина: способствуют своевременной экспрессии генов, участвуют в репарации повреждений и репликации ДНК. Но что конкретно делает серотонин, мы узнали только в 2019 году (L. Farrelly et al., 2019. Histone serotonylation is a permissive modification that enhances TFIID binding to H3K4me3).
Китайские и американские исследователи показали, что серотонин присоединяется к глутамину-5 гистона H3 (H3Q5-ser, рис. 2). Рядом с этим аминокислотным остатком находится еще важная модификация — лизин-4, который содержит три метильных группы (H3K4me3). Эта модификация — маркер активных промоторов тех генов, которые активно транскрибируются. Эти две модификации находятся друг рядом с другом неспроста. Как оказалось, серотонилирование помогает связаться белковому комплексу Транскрипционного фактора II D (TFIID) с промотором, меченым H3K4me3, и инициировать транскрипцию гена. То есть такая двойная метка служит фактором, дополнительно стимулирующим начало транскрипции генов. Серотонилирование гистона H3 наиболее ярко выражено в мозге и кишечнике — основных органах, вырабатывающих серотонин.

Когда исследователи сравнили, как отличается экспрессия генов в эпендимомах с ZR-FUS и без него, они обнаружили что ZR-FUS приводит к большей активности генов, которые связаны с образованием синапсов и функцией нейронов. Опухоль обладала повышенной нейронной активностью. Чтобы подтвердить эти наблюдения, авторы использовали метод DREADD (Designer Receptors Exclusively Activated by Designer Drugs — сконструированные рецепторы, которые активируются исключительно сконструированными молекулами). Этот метод — самый распространенный в нейробиологии способ направленно активировать определенные нейроны мозга. Достигается это введением в мозг генетических конструкций, кодирующих рецепторы, которые селективно связываются каким-либо определенным препаратом. В данном случае, авторы ввели в мозг новорожденных мышей с ZR-FUS-эпендимомой аденоассоциированные вирусы, которые кодировали рецептор hM3Dq (модифицированный вариант мускаринового рецептора 3 человека). Рецептор экспрессировался в нейронах, а затем его активировали с помощью N-оксида клозапина, что приводило к активации нейронов. При активации нейронов в том же полушарии, где находилась опухоль, начиналась активная пролиферация ее клеток (рис. 3, с, d).
Однако, это были нейроны всего полушария. Если ввести такие конструкции более точно, то можно активировать, например, ядра шва, которые выделяют серотонин. Сами клетки опухоли его синтезировать не могут, поэтому используют то, уже присутствует в мозге. И здесь уже ситуация была совершенно другой: пока ядра шва активировались, то есть выбрасывали больше серотонина, то опухоль уменьшалась в объеме (рис. 3, f, g). При торможении ядер шва аналогичным введением рецепторов hM4Di, рост опухоли увеличивался (рис. 3, i, j). Таким образом, авторы были уверены, что именно серотонин ограничивает рост опухоли, тем более что клетки эпендимомы способны поглощать серотонин.
На следующем этапе авторы погрузились в исследование роли серотонина, связанного с гистонами. Так как серотонин способен влиять на экспрессию генов, может ли он быть связан и с эпигенетическими изменениями, которые вызывает химерный белок ZR-FUS? Интересно, что в ZR-FUS-опухолях человека уровень двойной модификации гистона H3Q5-ser был выше, чем в эпендимомах с другими мутациями. Также он был выше в опухоли, чем в окружающей ткани (рис. 4, a, b, c).
Серотонилирование гистонов также влияло на выживаемость мышей с ZR-FUS-эпендимомой. Авторы экспрессировали в мышах гистон H3.3 с заменой глутамина 5 на аланин (H3.3-Q5A) — такая модификация не серотонилируется, при этом модифицированный гистон становится частью хроматина (рис. 4, d). Из 17 мышей с мутацией H3.3-Q5A только у четырех мышей образовались опухоли, причем даже в этих четырех случаях уровень серотонилирования был ниже, чем у контрольных животных, которые экспрессировали H3.3 дикого типа (рис. 4, e). Авторы сделали вывод, что серотонилирование гистонов стимулирует прогрессирование опухоли, в отличие от воздействия серотонина выброшенного нейронами дорсального ядра шва, которое сокращает ее рост. Кроме того, если блокировать обратный захват серотонина выделяющими его нейронами, то есть увеличивать количество доступного серотонина, то уровень серотонилирования гистона Н3 также снижается.
Для того, чтобы объяснить такие различия, исследователи изучили, на какие гены влияет серотонилирование гистонов. Для этого они использовали метод иммунопреципитации хроматина с последующим секвенированием (ChIP-seq). Так они обнаружили, что H3Q5-ser присутствует на участках открытого хроматина, а также там, где с ДНК связывается химерный белок ZR-FUS. Проанализировав последовательности ДНК, авторы обнаружили, что в этих же участках с ДНК могут связываться факторы транскрипции, которые вовлечены в развитие ZR-FUS-эпендимомы. Гипотеза исследователей состояла в том, что H3Q5-ser и белок ZR-FUS совместно увеличивают экспрессию факторов образования и поддержания опухоли.
Для того, чтобы обнаружить эти факторы применили подход, который называется in vivo скрининг с баркодированием. Гены 38 транскрипционных факторов-кандидатов, каждый из которых помечен отдельным «штрихкодом» из дополнительных нуклеотидов, помещали в транспозон PiggyBack. Он способен встраиваться в геном клеток, экспрессируя закодированный ген. Транспозоны вводили в эмбрионы мышей с ZR-FUS-эпендимомой. На 70 день у мышей выделяли опухоли и смотрели, сколько сигнала от каждого штрихкода можно обнаружить. Чем чаще в ДНК из клеток встречается определенный штрихкод, тем больше клеток выжило в процессе образования опухоли, и тем больше в ней транскрипционного фактора (впрочем, это можно изучить другими методами, которые авторы не использовали).
Четыре транскрипционных фактора встречались чаще: LHX2, LHX4, ETV5 и KLF12 (рис. 5, a). Однако оказалось, что если экспрессировать их по отдельности в опухоли, то только ETV5 ускоряет рост опухоли и снижает выживаемость мышей (рис. 5, b). Нокаут этого гена наоборот увеличивает выживаемость. Таким образом, ETV5 посчитали основным белком, регулирующим процессы транскрипции при ZR-FUS-эпендимоме. Увеличение экспрессии этого гена, как оказалось, делает гены менее доступными для транскрипции — хроматин в этих местах несет не метку активного хроматина H3K27ac (ацетилированным гистон H3 по лизину 27), а неактивного — H3K27me3 — триметилированного гистона H3 по лизину 27. Сам же транскрипционный фактор, как оказалось, связывается с большим количеством белков, участвующих в репрессии транскрипции и поддерживающих неактивное состояние хроматина. Таким образом, в ZR-FUS-эпендимоме транскрипционный фактор ETV5 снижает доступность ДНК для транскрипции.
Четыре транскрипционных фактора встречались чаще: LHX2, LHX4, ETV5 и KLF12 (рис. 5, a). Однако оказалось, что если экспрессировать их по отдельности в опухоли, то только ETV5 ускоряет рост опухоли и снижает выживаемость мышей (рис. 5, b). Нокаут этого гена наоборот увеличивает выживаемость. Таким образом, ETV5 посчитали основным белком, регулирующим процессы транскрипции при ZR-FUS-эпендимоме. Увеличение экспрессии этого гена, как оказалось, делает гены менее доступными для транскрипции — хроматин в этих местах несет не метку активного хроматина H3K27ac (ацетилированным гистон H3 по лизину 27), а неактивного — H3K27me3 — триметилированного гистона H3 по лизину 27. Сам же транскрипционный фактор, как оказалось, связывается с большим количеством белков, участвующих в репрессии транскрипции и поддерживающих неактивное состояние хроматина. Таким образом, в ZR-FUS-эпендимоме транскрипционный фактор ETV5 снижает доступность ДНК для транскрипции.
Среди генов, которые оказались «выключенными», одним из интересных локусов был ген Npy. Он кодирует внеклеточный нейропептид Y, который модулирует нейронную активность и участвует в поведенческих реакциях. Ранее он уже был изучен в контексте некоторых других опухолей, но первый раз «засветился» в регулировании развития эпендимом. Без него синаптическая активность вокруг опухоли увеличивается, что способствует росту опухоли. Если восстановить его экспрессию, то можно притупить и нейронную гиперактивность, и снизить рост эпендимомы.
При увеличении его экспрессии выживаемость мышей с ZR-FUS-эпендимомами вырастала, и, кроме того, снижалась синаптическая активность вокруг опухоли. Таким образом, NPY притупляет нейронную гиперактивность и рост опухоли. В ZR-FUS-эпендимомах экспрессия этого пептида приостановлена, что способствует активному делению опухолевых клеток.
Подводя итог, авторы делают вывод о том, что серотонин играет важную роль не только в синаптических сетях мозга, но и в сдерживании роста эпендимом через нейроны задних ядер шва. При этом активность нейронов коры ускоряет развитие опухоли. Это интересное наблюдение, ведь ранее было показано, что многие типы нейронной активности, включая речь и сенсорную информацию способствуют росту глиом. Однако в случае эпендимомы различные виды нейронов по-разному регулируют прогрессирование опухоли.
Тот факт, что серотонин является не только нейромедиатором, но и молекулой, которая напрямую регулирует активность генов, имеет важное значение для понимания различных заболеваний. Не исключено, что препараты, модулирующие функции серотонина, например антидепрессанты, со временем могут стать важной частью терапии не только психиатрических, но и других состояний.
Источник: Hsiao-Chi Chen, Peihao He, Malcolm McDonald, Michael R. Williamson, Srinidhi Varadharajan, Brittney Lozzi, Junsung Woo, Dong-Joo Choi, Debosmita Sardar, Emmet Huang-Hobbs, Hua Sun, Siri M. Ippagunta, Antrix Jain, Ganesh Rao, Thomas E. Merchant, David W. Ellison, Jeffrey L. Noebels, Kelsey C. Bertrand, Stephen C. Mack & Benjamin Deneen. Histone serotonylation regulates ependymoma tumorigenesis // Nature. 2024. DOI: 10.1038/s41586-024-07751-z.
Екатерина Грачева
 ТУР ПО МИРУ
ТУР ПО МИРУ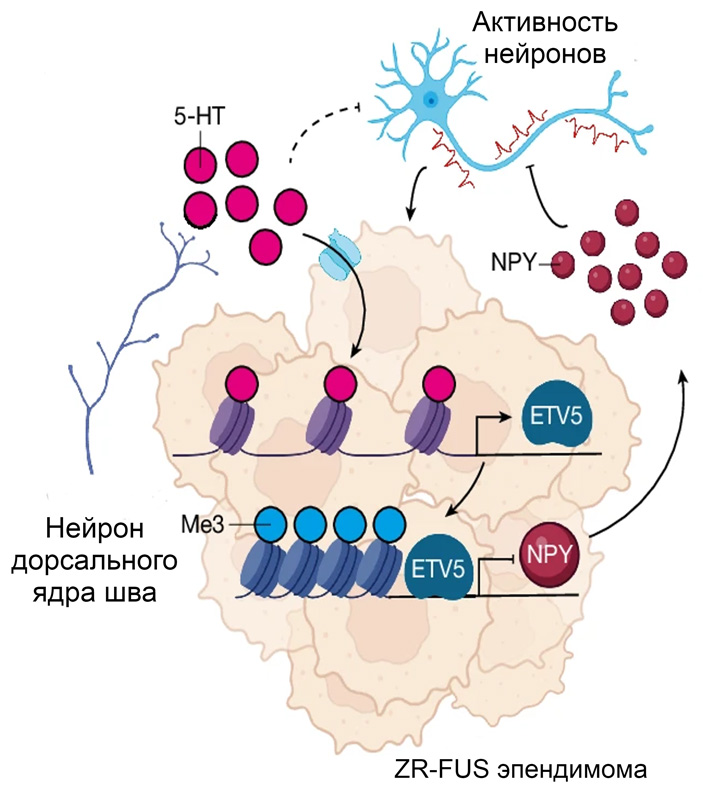












 Похожее:
Похожее:
